Miażdżyca – leczenie farmakologiczne
Miażdżyca to przewlekła choroba zapalna tętnic, która w ciszy rozwija się przez dziesiątki lat, by w końcu ujawnić swoją obecność w najbardziej dramatyczny sposób – zawałem serca, udarem mózgu czy niewydolnością krążenia. To schorzenie odpowiada za niemal połowę wszystkich zgonów w Polsce, gdzie co roku około 80 tysięcy osób doświadcza zawału serca, a 70-90 tysięcy – udaru mózgu. Europejskie Towarzystwo Kardiologiczne klasyfikuje nasz kraj jako region wysokiego ryzyka sercowo-naczyniowego, co oznacza, że z powodu chorób układu krążenia umiera u nas prawie dwukrotnie więcej ludzi niż w pozostałych krajach Unii Europejskiej. Paradoksalnie, choć miażdżyca stanowi jedno z największych wyzwań współczesnej medycyny, aż 80% jej powikłań można by zapobiec poprzez odpowiednio wcześnie wdrożoną profilaktykę i leczenie. Proces chorobowy rozpoczyna się już w dzieciństwie, często przed dziesiątym rokiem życia, kiedy w ścianach tętnic pojawiają się pierwsze nacieki tłuszczowe. Przez kolejne dekady blaszki miażdżycowe powoli rosną, zwężając światło naczyń, aż w końcu – najczęściej między 40. a 60. rokiem życia – prowadzą do pierwszych objawów klinicznych. Zrozumienie mechanizmów rozwoju miażdżycy oraz możliwości jej leczenia farmakologicznego jest kluczem do skutecznej walki z tą cichą epidemią XXI wieku.
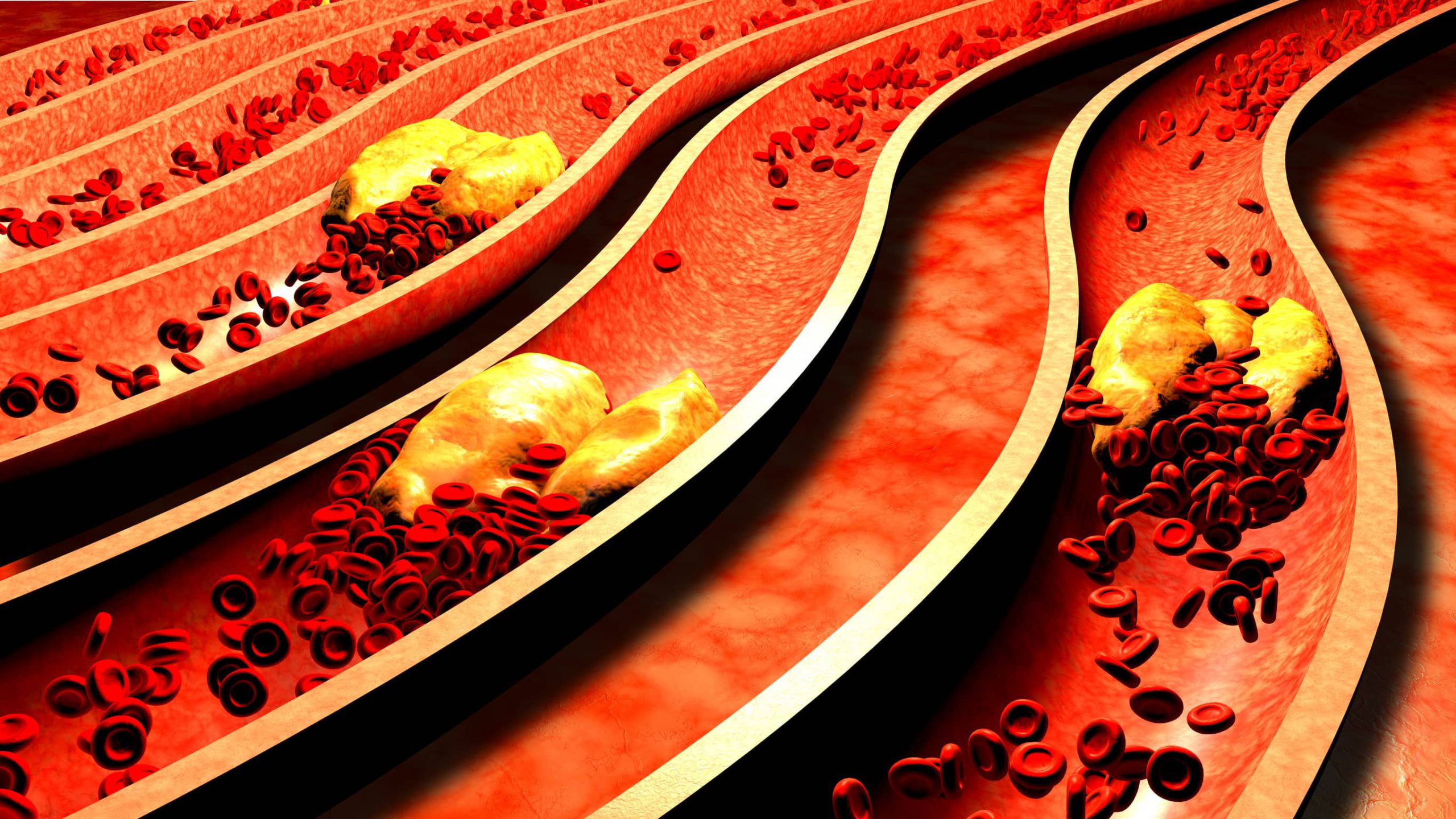
Czym jest miażdżyca i jak się rozwija?
Miażdżyca, znana również jako arterioskleroza, to złożony proces chorobowy, w którym w ścianach tętnic dochodzi do powstawania charakterystycznych struktur nazywanych blaszkami miażdżycowymi. Te formacje składają się z cholesterolu, tłuszczów, komórek zapalnych, komórek mięśni gładkich oraz tkanki łącznej. Z biegiem lat blaszki powiększają się, twardnieją i mogą ulegać zwapnieniu, prowadząc do zwężenia światła naczynia i ograniczenia przepływu krwi do zaopatrywanych przez nie narządów.
Proces miażdżycowy rozpoczyna się, gdy cząsteczki cholesterolu LDL – potocznie nazywanego „złym cholesterolem” – przenikają przez uszkodzony śródbłonek naczynia i gromadzą się w jego ścianie. Organizm traktuje to jako sygnał zagrożenia i wysyła do miejsca „ataku” komórki obronne układu odpornościowego – monocyty. Po przedostaniu się do ściany naczynia monocyty przekształcają się w makrofagi, które zaczynają pochłaniać nagromadzony cholesterol. W miarę wypełniania się tłuszczem makrofagi przybierają charakterystyczny wygląd i zaczynają być nazywane „komórkami piankowatymi” – to właśnie one stanowią budulec dla rozwijającej się blaszki miażdżycowej.
W miarę narastania procesu zapalnego blaszka stopniowo powiększa się, wpuklając się do światła tętnicy. Szczególnie niebezpieczne są młode, niestabilne blaszki miażdżycowe, które mają cienką pokrywę włóknistą i duże lipidowe jądro. Paradoksalnie, to właśnie one – często jeszcze niezwężające znacząco naczynia – są najbardziej podatne na pęknięcie. Gdy dojdzie do uszkodzenia blaszki, odsłonięty zostaje jej wnętrze, co uruchamia proces krzepnięcia krwi. Powstały zakrzep może całkowicie zablokować naczynie, prowadząc do zawału serca, udaru mózgu lub ostrego niedokrwienia innych narządów.
Badania autopsyjne przeprowadzone u młodych osób, które zginęły w wypadkach, ujawniły obecność wczesnych zmian miażdżycowych już w wieku nastoletnim, a nawet u dzieci. U 24% kobiet i 36% mężczyzn stwierdza się obecność subklinicznej miażdżycy tętnic szyjnych. W populacji osób w wieku 30-79 lat aż 32% kobiet i 23% mężczyzn ma pogrubioną błonę środkową tętnicy szyjnej, co jest wczesnym markerem procesu miażdżycowego. Te niepokojące dane pokazują, że miażdżyca to problem, który dotyczy nie tylko seniorów, ale również osób młodych, często nieświadomych rozwijającej się w ich organizmie choroby.
Epidemiologia i skala problemu w Polsce
Choroby układu krążenia pochodzenia miażdżycowego stanowią główną przyczynę zgonów w Polsce i na świecie. Według aktualnych danych epidemiologicznych odpowiadają one za około 37-46% wszystkich zgonów w naszym kraju, przy czym kobiety dotknięte są nimi nieco częściej niż mężczyźni – w 2020 roku choroby sercowo-naczyniowe były przyczyną 41% zgonów kobiet i 33% zgonów mężczyzn. Każdego roku niemal 75 tysięcy osób w Polsce doświadcza udaru mózgu, a około 80 tysięcy zawału serca. Rocznie z powodu chorób układu krążenia umiera ponad 170 tysięcy Polaków.
Szczególnie niepokojąca jest sytuacja dotycząca zaburzeń lipidowych, które stanowią główny modyfikowalny czynnik ryzyka miażdżycy. Problem ten dotyczy nawet 60% dorosłych Polaków, a w niektórych grupach wiekowych odsetek ten jest jeszcze wyższy. Badanie NATPOL 2011 wykazało, że hipercholesterolemia występuje u znacznej części społeczeństwa, jednak u zaledwie co czwartego pacjenta udaje się osiągnąć docelowy poziom cholesterolu LDL poniżej 100 mg/dl. W grupie osób z największym ryzykiem sercowo-naczyniowym pożądane wartości LDL (poniżej 70 mg/dl) osiąga mniej niż 10% chorych, co oznacza, że ogromna większość pacjentów jest niedostatecznie leczona.
Nadciśnienie tętnicze, kolejny kluczowy czynnik ryzyka miażdżycy, dotyczy niemal co trzeciego dorosłego Polaka (około 31% populacji). Na choroby serca takie jak choroba niedokrwienna serca, wada zastawki serca, niewydolność serca, migotanie przedsionków i miażdżyca cierpi co ósmy mieszkaniec naszego kraju. Niepokojącym trendem jest również coraz częstsze występowanie udaru mózgu u osób młodszych – aż 30% pacjentów z udarem mózgu ma mniej niż 65 lat, co jest efektem współczesnego stylu życia i narastającej epidemii cukrzycy oraz otyłości.
Czynniki ryzyka rozwoju miażdżycy
Rozwój miażdżycy jest procesem wieloczynnikowym, w którym uczestniczą zarówno czynniki genetyczne, jak i środowiskowe. Możemy je podzielić na dwie główne kategorie: modyfikowalne, na które mamy bezpośredni wpływ, oraz niemodyfikowalne, których nie jesteśmy w stanie zmienić.
Czynniki niemodyfikowalne
Do czynników, których nie możemy zmienić, należą przede wszystkim wiek – ryzyko miażdżycy wzrasta wraz z upływem lat, szczególnie po 65. roku życia. Płeć również odgrywa istotną rolę: mężczyźni są bardziej narażeni na choroby sercowo-naczyniowe do momentu menopauzy u kobiet, po której ryzyko wyrównuje się. Predyspozycje genetyczne i rodzinne występowanie chorób sercowo-naczyniowych znacząco zwiększają prawdopodobieństwo rozwoju miażdżycy – geny odpowiedzialne za metabolizm lipidów mają fundamentalne znaczenie w patogenezie tej choroby.
Czynniki modyfikowalne
Najważniejszym modyfikowalnym czynnikiem ryzyka jest dyslipidemia, czyli zaburzenia w gospodarce lipidowej. Obejmuje ona podwyższony poziom cholesterolu całkowitego, wysoki poziom cholesterolu LDL (frakcji lipoprotein niskiej gęstości), niski poziom cholesterolu HDL (frakcji lipoprotein wysokiej gęstości) oraz podwyższony poziom trójglicerydów. Związek między stężeniem cholesterolu LDL a ryzykiem chorób sercowo-naczyniowych został bezspornie udowodniony w licznych badaniach genetycznych, obserwacyjnych i interwencyjnych. Co więcej, ryzyko to zależy nie tylko od stopnia podwyższenia LDL, ale również od czasu trwania ekspozycji na podwyższone wartości – stąd koncepcja „cholesterolo-lat”, która podkreśla znaczenie wczesnego rozpoczęcia leczenia hipolipemizującego.
Nadciśnienie tętnicze to drugi po dyslipidemii najważniejszy czynnik ryzyka rozwoju miażdżycy i jej powikłań. Polska uznawana jest za kraj wysokiego ryzyka nadciśnieniowego, a kontrola ciśnienia u pacjentów pozostaje niezadowalająca. Palenie tytoniu stanowi jeden z najsilniejszych czynników ryzyka – jest drugim po nadciśnieniu najważniejszym modyfikowalnym czynnikiem prowadzącym do chorób sercowo-naczyniowych. Na całym świecie palenie tytoniu odpowiada za połowę wszystkich zgonów, których można było uniknąć u palaczy. U osoby palącej przez większość życia istnieje 50% prawdopodobieństwo zgonu z powodu palenia oraz stwierdza się utratę średnio 10 lat życia.
Cukrzyca zwiększa dwukrotnie ryzyko rozwoju chorób sercowo-naczyniowych związanych z miażdżycą. Co szczególnie niepokojące, co jedenasty dorosły na świecie ma obecnie zdiagnozowaną cukrzycę, a w Polsce jedna na cztery osoby powyżej 60. roku życia cierpi na to schorzenie. Kobiety z cukrzycą typu 2 charakteryzują się szczególnie wysokim ryzykiem udaru mózgu. Otyłość, szczególnie typu brzusznego, wraz z upływem lat prowadzi do licznych nieprawidłowości metabolicznych i wzrostu ciśnienia tętniczego, co promuje i przyspiesza rozwój miażdżycy. W Polsce problem choroby otyłościowej dotyka co piątego Polaka.
Przewlekły stres odgrywa również istotną rolę w rozwoju miażdżycy. Podczas stresu dochodzi do aktywacji układu współczulnego i wzrostu wydzielania hormonów stresu (kortyzolu, adrenaliny), które mogą podwyższać ciśnienie tętnicze, zwiększać stężenie glukozy we krwi, nasilać stan zapalny w organizmie oraz promować odkładanie tłuszczu trzewnego.
Objawy miażdżycy w zależności od lokalizacji
Miażdżyca przez wiele lat może przebiegać całkowicie bezobjawowo. Pierwsze symptomy pojawiają się zazwyczaj dopiero wtedy, gdy blaszka miażdżycowa zwęża światło tętnicy o ponad 50-70%. Charakter objawów zależy przede wszystkim od tego, które naczynia zostały dotknięte procesem chorobowym.
Gdy miażdżyca rozwija się w tętnicach wieńcowych, zaopatrujących w krew mięsień sercowy, prowadzi do powstania choroby niedokrwiennej serca. Najczęstszym objawem jest ból wieńcowy, nazywany również dławicą piersiową – uczucie ucisku, pieczenia lub dławienia za mostkiem, które pojawia się podczas wysiłku fizycznego i ustępuje po odpoczynku. Ból może promieniować do lewego barku, ramienia, szyi lub żuchwy. Pacjenci zgłaszają również duszność, szczególnie przy wysiłku, oraz szybsze męczenie się przy niewielkim obciążeniu. W najgorszym scenariuszu dochodzi do zawału serca – stanu, w którym nagłe zamknięcie światła tętnicy wieńcowej prowadzi do martwicy mięśnia sercowego. Zawał rozwija się już w 15-30 minut po zatrzymaniu dopływu krwi i objawia się bardzo silnym bólem w klatce piersiowej, często z uczuciem duszności, zlewnym, zimnym potem i utratą przytomności.
Miażdżyca tętnic kończyn dolnych manifestuje się charakterystycznym objawem zwanym chromaniem przestankowym – silnym bólem mięśni łydek, który pojawia się podczas chodzenia lub biegania i zmusza pacjenta do zatrzymania się. Po kilku minutach odpoczynku ból ustępuje, ale powraca po ponownym podjęciu marszu. Dodatkowo występuje drętwienie i sztywność mięśni nóg, zimna i blada skóra kończyn, osłabienie tętna na stopach oraz trudności z gojeniem się ran. W zaawansowanych przypadkach może dojść do martwicy tkanek i gangreny, co grozi amputacją.
Miażdżyca tętnic szyjnych i mózgowych prowadzi do niedotlenienia mózgu i może objawiać się zawrotami głowy, bólami głowy, zaburzeniami widzenia (przemijające zaniewidzenie jednego oka), problemami z mową i równowagą oraz drętwieniem lub osłabieniem twarzy i kończyn. Objawem ostrzegawczym są przemijające ataki niedokrwienne (TIA), które trwają krócej niż 24 godziny, ale często zwiastują nadchodzący udar mózgu. W przypadku udaru dochodzi do nagłego zamknięcia światła naczyń doprowadzających krew do mózgu, co prowadzi do uszkodzenia tkanki nerwowej. Objawy obejmują zaburzenia mowy, porażenie nerwu twarzowego (opadanie kącika ust), niedowłady lub paraliże kończyn oraz zaburzenia czucia. Każdego roku w Polsce co osiem minut ktoś przechodzi udar mózgu, a ponad 30 tysięcy Polaków umiera z tego powodu.
Miażdżyca tętnic nerkowych objawia się trudnym do kontrolowania nadciśnieniem tętniczym, pogorszeniem funkcji nerek oraz obrzękami. W przypadku miażdżycy aorty brzusznej pacjenci mogą odczuwać ból w dolnej części pleców oraz istnieje ryzyko rozwoju groźnego tętniaka aorty brzusznej, który w przypadku pęknięcia prowadzi do masywnego krwotoku wewnętrznego.
Diagnostyka miażdżycy
Wczesne wykrycie miażdżycy jest kluczowe dla skutecznego zapobiegania jej powikłaniom. Proces diagnostyczny obejmuje kompleksową ocenę stanu naczyń krwionośnych przy użyciu różnorodnych metod badawczych.
Podstawą jest dokładny wywiad lekarski, podczas którego lekarz pyta o obecność typowych objawów oraz ocenia czynniki ryzyka. Następnie przeprowadza badanie fizykalne, zwracając uwagę na osłuchanie tętnic (w poszukiwaniu szmerów), badanie tętna na różnych odcinkach ciała oraz pomiar wskaźnika kostka-ramię (ABI), który pozwala ocenić stopień zwężenia tętnic kończyn dolnych.
Badania laboratoryjne obejmują przede wszystkim pełny lipidogram (cholesterol całkowity, LDL, HDL, trójglicerydy), poziom glukozy na czczo i hemoglobinę glikowaną (HbA1c), badania funkcji nerek (kreatynina, eGFR) i wątroby (AspAT, AlAT) oraz markery stanu zapalnego (białko C-reaktywne). Te podstawowe badania pozwalają ocenić stopień zaburzeń metabolicznych i ryzyko sercowo-naczyniowe.
Badania obrazowe i czynnościowe są niezbędne do oceny zaawansowania zmian miażdżycowych. USG Doppler tętnic (szyjnych, kończyn) to nieinwazyjne badanie, które pozwala dokonać oceny stanu i wydolności naczyń krwionośnych. Głowica aparatu USG wysyła falę ultradźwiękową przenikającą przez ciało i odbijającą się od krwi – na podstawie zmian częstotliwości fali dźwiękowej lekarz może zobaczyć, gdzie przepływ krwi jest wolniejszy lub całkowicie zablokowany. Elektrokardiogram (EKG) i próba wysiłkowa pozwalają ocenić pracę serca i wykryć niedokrwienie mięśnia sercowego. Echokardiografia ocenia strukturę i czynność serca, a tomografia komputerowa tętnic wieńcowych umożliwia bezpośrednią wizualizację blaszek miażdżycowych. W przypadkach wątpliwych lub przed planowanym zabiegiem wykonuje się koronarografię (angiografię tętnic wieńcowych), która jest złotym standardem w ocenie zwężeń naczyń wieńcowych.
Leczenie farmakologiczne miażdżycy
Farmakoterapia miażdżycy stanowi fundament nowoczesnego podejścia do tej choroby i koncentruje się na kilku kluczowych celach: obniżeniu poziomu cholesterolu LDL, stabilizacji blaszek miażdżycowych, redukcji stanu zapalnego oraz zmniejszeniu ryzyka powstawania zakrzepów. Dzięki prawidłowo dobranej i konsekwentnie stosowanej farmakoterapii możliwe jest znaczące obniżenie ryzyka zawału serca i udaru mózgu.
Leki hipolipemizujące – podstawa terapii
Statyny – najważniejsza grupa leków
Statyny stanowią absolutną podstawę farmakologicznego leczenia miażdżycy i są lekami pierwszego wyboru w terapii hipercholesterolemii. Ich mechanizm działania polega na hamowaniu enzymu HMG-CoA reduktazy, który jest kluczowy w produkcji cholesterolu w wątrobie. Dzięki temu statyny obniżają poziom cholesterolu LDL nawet o 30-50%, a przy wysokich dawkach redukcja może sięgać 60%. Co równie istotne, statyny wykazują działanie plejotropowe – niezależnie od obniżania cholesterolu działają przeciwzapalnie, stabilizują blaszkę miażdżycową poprzez zmniejszenie jej lipidowego rdzenia i wzmocnienie pokrywy włóknistej, poprawiają funkcję śródbłonka naczyniowego oraz wykazują właściwości przeciwzakrzepowe.
Badania kliniczne jednoznacznie potwierdzają skuteczność statyn w redukcji ryzyka sercowo-naczyniowego. Badanie WOSCOP jako pierwsze wykazało korzyści z zastosowania statyn w prewencji pierwotnej u mężczyzn z hipercholesterolemią. Badanie MAAS oceniało wpływ simwastatyny na progresję miażdżycy tętnic wieńcowych i wykazało, że statyna znacznie ograniczyła postęp miażdżycy, choć nie była w stanie całkowicie odwrócić tego procesu. Badania z zastosowaniem tomografii komputerowej wykazały, że intensywne leczenie statynami prowadzące do obniżenia cholesterolu LDL poniżej 120 mg/dl wiąże się z przeciętnie 7-10% zmniejszeniem objętości blaszek miażdżycowych.
W Polsce dostępne są następujące statyny:
Atorwastatyna (preparaty: Atoris, Sortis, Tulip, Torvacard) – jedna z najsilniejszych i najczęściej przepisywanych statyn. Stosowana w dawkach od 10 do 80 mg raz dziennie, wieczorem. Jest szczególnie skuteczna w obniżaniu poziomu LDL i dobrze tolerowana przez pacjentów. Zalecana u chorych z wysokim i bardzo wysokim ryzykiem sercowo-naczyniowym.
Rosuwastatyna (preparaty: Crestor, Roswera, Rosuvastatin) – najsilniejsza dostępna statyna, charakteryzująca się największą skutecznością w redukcji LDL. Stosowana w dawkach 5-40 mg raz dziennie. Szczególnie wskazana u pacjentów, którzy nie osiągnęli celu terapeutycznego na innych statynach lub wymagają bardzo dużej redukcji cholesterolu.
Simwastatyna (preparaty: Zocor, Simvasterol, Simvastatin) – jedna z pierwszych statyn wprowadzonych do leczenia, stosowana w dawkach 10-40 mg wieczorem. Choć nieco mniej skuteczna niż nowsze statyny, pozostaje ważną opcją terapeutyczną, szczególnie w niższych dawkach.
Prawastatyna (preparat: Pravasine) – statyna o umiarkowanej sile działania, stosowana w dawkach 10-40 mg. Charakteryzuje się dobrym profilem bezpieczeństwa i jest preferowana u pacjentów starszych lub z wielochorobowością.
Fluwastatyna (preparat: Lescol) – najsłabsza z dostępnych statyn, stosowana w dawkach 20-80 mg. Może być wybierana u pacjentów z łagodną hipercholesterolemią lub nietolerujących silniejszych statyn.
Leczenie statyną należy rozpoczynać od małych lub średnich dawek i stopniowo je zwiększać, kontrolując poziom cholesterolu oraz enzymy wątrobowe. U pacjentów z bardzo wysokim ryzykiem sercowo-naczyniowym zaleca się osiągnięcie poziomu LDL poniżej 55 mg/dl, u pacjentów wysokiego ryzyka poniżej 70 mg/dl, a u osób z umiarkowanym ryzykiem poniżej 100 mg/dl.
Najczęstsze działania niepożądane statyn to bóle i osłabienie mięśni (miopatia), które występują u 5-10% pacjentów. Rzadziej może dojść do podwyższenia enzymów wątrobowych. U pacjentów przyjmujących statyny długotrwale w wysokich dawkach istnieje nieznacznie zwiększone ryzyko rozwoju cukrzycy typu 2. Bardzo rzadkim, ale groźnym powikłaniem jest rabdomioliza – rozpad mięśni prążkowanych prowadzący do niewydolności nerek. Ryzyko to jest szczególnie zwiększone przy jednoczesnym stosowaniu niektórych leków (fibraty, kwas nikotynowy).
Ezetimib – wspomaganie działania statyn
Ezetimib (preparaty: Ezetrol, Ezolip, Ezen, Ezetimibe) działa w jelicie cienkim, hamując wchłanianie cholesterolu zarówno pochodzącego z pożywienia, jak i wydzielanego z żółcią. Sam ezetimib obniża poziom LDL o około 15-20%, jednak jego główną zaletą jest możliwość stosowania w skojarzeniu ze statyną, co pozwala na uzyskanie synergistycznego efektu hipolipemizującego. Badania wykazały, że dodanie ezetimibu do statyny u pacjentów, którzy nie osiągnęli celu terapeutycznego, pozwala na dodatkowe obniżenie LDL o 20-25%.
Ezetimib stosuje się w dawce 10 mg raz dziennie, niezależnie od posiłków. Lek jest bardzo dobrze tolerowany, a działania niepożądane występują rzadko. Dostępne są również preparaty złożone zawierające ezetimib w połączeniu ze statyną, takie jak Inegy (ezetimib + simwastatyna), Atozet (ezetimib + atorwastatyna) czy Rosuzet (ezetimib + rosuwastatyna), które ułatwiają przestrzeganie zaleceń terapeutycznych.
Fibraty – leki obniżające trójglicerydy
Fibraty działają głównie poprzez aktywację receptorów PPAR-alfa, co prowadzi do zwiększenia aktywności lipazy lipoproteinowej – enzymu rozkładającego trójglicerydy. Skutkują obniżeniem poziomu trójglicerydów nawet o 30-50%, podwyższeniem HDL o 10-20% oraz umiarkowanym obniżeniem LDL. Są lekami z wyboru u pacjentów z hipertriglicerydemią, szczególnie gdy poziom trójglicerydów przekracza 400 mg/dl, co stwarza ryzyko ostrego zapalenia trzustki.
W Polsce dostępne są następujące fibraty:
Fenofibrat (preparaty: Fenardin, Lipanthyl, Fenofibrate) – najczęściej stosowany fibrat, podawany w dawce 145-200 mg raz dziennie. Wykazuje największą skuteczność w obniżaniu trójglicerydów i jest najlepiej przebadany klinicznie.
Ciprofibrat (preparat: Lipanor) – stosowany w dawce 100 mg raz dziennie. Charakteryzuje się długim czasem półtrwania i dobrą tolerancją.
Fibraty mogą powodować dyspepsję, bóle brzucha oraz zwiększają ryzyko kamicy żółciowej. Szczególnie ostrożnie należy je stosować w skojarzeniu ze statynami ze względu na zwiększone ryzyko miopatii. U pacjentów z zaburzeniami czynności nerek wymagana jest redukcja dawki.
Kwasy omega-3
Kwasy tłuszczowe omega-3, szczególnie EPA (kwas eikozapentaenowy) i DHA (kwas dokozaheksaenowy), wykazują działanie obniżające poziom trójglicerydów, działanie przeciwzapalne oraz korzystny wpływ na funkcję śródbłonka naczyniowego. W wysokich dawkach (2-4 g dziennie) mogą obniżyć trójglicerydy o 20-30%. Dostępne są jako leki na receptę (Omacor, Omevital) oraz jako suplementy diety.
Inhibitory PCSK9 – przełom w leczeniu hipercholesterolemii
Inhibitory konwertazy proproteinowej subtylizyny/keksyny typu 9 (PCSK9) to nowoczesna grupa leków biologicznych, która rewolucjonizuje leczenie ciężkiej hipercholesterolemii. Białko PCSK9 wiąże się z receptorami dla LDL na powierzchni hepatocytów i powoduje ich degradację, co zmniejsza wychwyt cholesterolu z krwi. Inhibitory PCSK9 blokują to białko, zwiększając liczbę receptorów LDL na powierzchni komórek wątroby, co prowadzi do intensywnego usuwania „złego cholesterolu” z osocza.
W Polsce w ramach programu lekowego B101 dostępne są następujące leki:
Ewolokumab (preparat: Repatha) – ludzkie przeciwciało monoklonalne klasy IgG2, podawane podskórnie w dawce 140 mg co 2 tygodnie lub 420 mg raz w miesiącu. Obniża poziom LDL o 55-60%, a w połączeniu ze statyną i ezetymibem redukcja może sięgać nawet 85%. Maksymalne stężenie w osoczu osiąga po 3-4 dniach, a czas półtrwania wynosi 11-17 dni.
Alirokumab (preparat: Praluent) – drugie dostępne przeciwciało monoklonalne, stosowane w dawce 150 mg co 2 tygodnie lub 300 mg co 4 tygodnie. Skuteczność porównywalna z ewolokumabem – obniża LDL o 50-60%.
Inklisiran (preparat: Leqvio) – mały interferujący RNA (siRNA), który hamuje syntezę białka PCSK9 w hepatocytach. Podawany w iniekcjach podskórnych: pierwsza dawka, następnie po 3 miesiącach druga dawka, a kolejne iniekcje co 6 miesięcy. Taki schemat dawkowania znacznie ułatwia przestrzeganie zaleceń terapeutycznych w porównaniu z częstszymi wstrzyknięciami innych inhibitorów PCSK9.
Inhibitory PCSK9 są refundowane w Polsce wyłącznie w ramach programu lekowego dla pacjentów z heterozygotyczną lub homozygotyczną postacią hipercholesterolemii rodzinnej, którzy mimo intensywnego leczenia statynami (w maksymalnie tolerowanych dawkach przez 3 miesiące) w skojarzeniu z ezetymibem nie osiągają docelowych wartości LDL. W programie leczonych jest obecnie około 1200 chorych, głównie w około 50 ośrodkach w całej Polsce. Leki te charakteryzują się bardzo dobrym profilem bezpieczeństwa – najczęstsze działanie niepożądane to łagodne reakcje w miejscu wstrzyknięcia (rumień, ból, opuchlizna), które szybko przemijają.
Leki przeciwpłytkowe – zapobieganie zakrzepom
Leki przeciwpłytkowe stanowią kluczowy element farmakoterapii miażdżycy, zapobiegając tworzeniu się zakrzepów na niestabilnych blaszkach miażdżycowych i znacząco redukując ryzyko zawału serca i udaru mózgu.
Kwas acetylosalicylowy (preparaty: Acard, Aspirin Cardio, Polocard, Polopyrin) – podstawowy lek przeciwpłytkowy, stosowany w prewencji pierwotnej u pacjentów z wysokim ryzykiem sercowo-naczyniowym oraz w prewencji wtórnej u wszystkich chorych z rozpoznaną chorobą sercowo-naczyniową. Mechanizm działania polega na nieodwracalnym hamowaniu cyklooksygenazy-1, co blokuje syntezę tromboksanu A2 – silnego aktywatora płytek krwi. Stosowany w dawkach kardiologicznych 75-150 mg raz dziennie (najczęściej 75 mg). Mimo niskich dawek może powodować działania niepożądane ze strony przewodu pokarmowego (krwawienia, owrzodzenia), dlatego u pacjentów z grup ryzyka zaleca się jednoczesne stosowanie inhibitorów pompy protonowej.
Klopidogrel (preparaty: Plavix, Clopidogrel KRKA, Plagrel) – antagonista receptora P2Y12 na płytkach krwi, stosowany w dawce 75 mg raz dziennie. Jest lekiem alternatywnym dla kwasu acetylosalicylowego u pacjentów z nietolerancją ASA lub stosowany łącznie z nim (tzw. podwójna terapia przeciwpłytkowa) przez określony czas po ostrych zespołach wieńcowych lub po zabiegach przezskórnej interwencji wieńcowej z implantacją stentu.
Tikagreltor (preparat: Brilique) i prasugrel – nowsze, silniejsze leki przeciwpłytkowe, stosowane głównie w ostrych zespołach wieńcowych. Tikagreltor podawany jest w dawce 2 x 90 mg, a prasugrel w dawce 10 mg raz dziennie (5 mg u osób o masie ciała poniżej 60 kg lub starszych niż 75 lat).
Tiklopidyna (preparat: Aclotin) – rzadziej stosowana ze względu na działania niepożądane, w tym ryzyko agranulocytozy. Dawkowanie: 250 mg dwa razy dziennie.
Leki hipotensyjne w terapii miażdżycy
Właściwa kontrola ciśnienia tętniczego jest kluczowym elementem leczenia miażdżycy. Wytyczne z 2024 roku rekomendują jako „podstawową trójkę” leków pierwszego wyboru: inhibitory konwertazy angiotensyny (ACE-I)/antagonistów receptora angiotensyny (sartany), antagonistów wapnia oraz diuretyki tiazydopodobne.
Inhibitory konwertazy angiotensyny (ACE-I)
Inhibitory ACE to leki pierwszego rzutu w leczeniu nadciśnienia tętniczego, szczególnie u pacjentów z chorobą wieńcową, po zawale serca, z niewydolnością serca, cukrzycą czy przewlekłą chorobą nerek. Mechanizm działania polega na hamowaniu enzymu konwertującego angiotensynę I w angiotensynę II, co prowadzi do rozszerzenia naczyń i obniżenia ciśnienia. Dodatkowo ACE-I hamują rozkład bradykininy, co wzmacnia ich działanie kardioprotekcyjne, przeciwmiażdżycowe i nefroprotekcyjne.
Najczęściej stosowane ACE-I w Polsce to:
Ramipril (preparaty: Tritace, Polpril, Vivace) – dawkowanie 2,5-10 mg raz dziennie, lek szczególnie dobrze przebadany u pacjentów po zawale serca i z wysokim ryzykiem sercowo-naczyniowym.
Perindopril (preparaty: Prestarium, Coverex, Perineva) – dawkowanie 4-8 mg raz dziennie, wykazuje długie działanie i bardzo dobry profil bezpieczeństwa.
Enalapril (preparaty: Enarenal, Enap, Enapril) – dawkowanie 5-40 mg, zwykle w dwóch dawkach podzielonych, jeden z najstarszych i najlepiej przebadanych ACE-I.
Lizynopryl (preparaty: Dapril, Liprimar) – dawkowanie 5-40 mg raz dziennie, nie jest metabolizowany w wątrobie, co czyni go bezpiecznym u pacjentów z chorobami wątroby.
Kaptopril (preparat: Captopril) – krótkodzialający ACE-I, stosowany w dawce 12,5-150 mg w 2-3 dawkach podzielonych, obecnie głównie w ostrych stanach lub u pacjentów z chorobą nerek.
Najczęstszym działaniem niepożądanym inhibitorów ACE jest suchy, uporczywy kaszel, występujący u 10-20% pacjentów. W takich przypadkach lekarz zazwyczaj zamienia lek na sartan. Rzadziej może wystąpić hiperkaliemia, pogorszenie funkcji nerek czy obrzęk naczynioruchowy. ACE-I są bezwzględnie przeciwwskazane w ciąży.
Antagoniści receptora angiotensyny (sartany)
Sartany blokują receptor AT1 dla angiotensyny II, wywołując podobny efekt hipotensyjny jak ACE-I, ale bez wpływu na bradykininę. Są lekami drugiego rzutu u pacjentów z nietolerancją ACE-I lub stosowane równolegle u osób z niskim i średnim ryzykiem sercowo-naczyniowym.
Najczęściej stosowane sartany:
Losartan (preparaty: Lorista, Cozaar) – dawkowanie 50-100 mg raz dziennie.
Walsartan (preparaty: Diovan, Valsacombi) – dawkowanie 80-320 mg raz dziennie.
Telmisartan (preparaty: Micardis, Tolura) – dawkowanie 40-80 mg raz dziennie.
Olmesartan (preparat: Olmetec) – dawkowanie 10-40 mg raz dziennie.
Sartany są bardzo dobrze tolerowane i rzadko powodują działania niepożądane. Nie wywołują kaszlu, co czyni je doskonałą alternatywą dla ACE-I u pacjentów z tym problemem.
Beta-blokery
Beta-adrenolityki nie należą do „podstawowej trójki” leków hipotensyjnych w miażdżycy, ale mają szczególne znaczenie u pacjentów z chorobą wieńcową, po zawale serca, z niewydolnością serca czy zaburzeniami rytmu. Wyniki badań z zastosowaniem karwedilolu, bisoprololu, bursztynianu metoprololu i nebiwololu potwierdziły korzystny wpływ tych leków na rokowanie u pacjentów z niewydolnością serca z obniżoną frakcją wyrzutową.
Bisoprolol (preparaty: Bisocard, Concor) – dawkowanie 2,5-10 mg raz dziennie, wysoce selektywny beta-1-bloker.
Metoprolol (preparaty: Betaloc ZOK, Metocard) – dostępny w formie o powolnym uwalnianiu, dawkowanie 25-200 mg raz dziennie.
Nebiwolol (preparaty: Nebilet, Binelol) – dawkowanie 5 mg raz dziennie, charakteryzuje się dodatkowymi właściwościami wazodylatacyjnymi dzięki uwalnianiu tlenku azotu.
Karwedilol (preparat: Dilatrend) – nieselektywny beta-bloker o dodatkowym działaniu alfa-1-blokującym, dawkowanie 12,5-50 mg dziennie w dawkach podzielonych.
Antagoniści wapnia
Blokery kanałów wapniowych rozszerzają naczynia krwionośne i obniżają ciśnienie tętnicze. Szczególnie wskazane są u osób starszych oraz w monoterapii lub w skojarzeniu z innymi lekami.
Amlodypina (preparaty: Norvasc, Amlozek) – długodziałający lek z grupy pochodnych dihydropirydyny, dawkowanie 5-10 mg raz dziennie.
Lacydypina – dawkowanie 4-6 mg raz dziennie.
Werapamil i diltiazem – antagoniści wapnia niedzihydropirydynowi, mają również działanie antyarytmiczne.
Diuretyki
Leki moczopędne zwiększają wydalanie sodu i wody przez nerki, zmniejszając objętość krwi krążącej i obniżając ciśnienie.
Indapamid (preparaty: Tertensif, Indapen) – diuretyk tiazydopodobny, dawkowanie 1,5-2,5 mg raz dziennie.
Hydrochlorotiazyd – klasyczny diuretyk tiazydowy, dawkowanie 12,5-25 mg raz dziennie.
Torasemid i furosemid – diuretyki pętlowe, stosowane głównie w niewydolności serca.
Leki przeciwcukrzycowe o działaniu kardioprotekcyjnym
U pacjentów z cukrzycą i miażdżycą niezwykle istotne jest nie tylko kontrolowanie poziomu glukozy, ale również wybór leków przeciwcukrzycowych, które dodatkowo chronią układ sercowo-naczyniowy.
Inhibitory SGLT-2 (flozyny) – empagliflozyna (Jardiance), dapagliflozyna (Forxiga), kanagliflozyna – wykazują udowodnione działanie kardioprotekcyjne i nefroprotekcyjne. Zmniejszają ryzyko hospitalizacji z powodu niewydolności serca oraz spowalniają postęp przewlekłej choroby nerek. Wytyczne jasno wskazują: w przypadku niewydolności serca i cukrzycy flozyny powinny być lekami pierwszego wyboru.
Agoniści receptora GLP-1 – liraglutyd (Victoza), semaglutyd (Ozempic), dulaglutyd (Trulicity) – obniżają masę ciała, poprawiają kontrolę glikemii i wykazują korzystny wpływ na układ sercowo-naczyniowy. U pacjentów z cukrzycą i wysokim ryzykiem sercowo-naczyniowym należy stosować flozynę lub analog GLP-1.
Metformina – pozostaje lekiem pierwszego wyboru u większości pacjentów z cukrzycą typu 2, wykazuje korzystny wpływ na metabolizm i profil lipidowy.
Leczenie zabiegowe miażdżycy
W zaawansowanych przypadkach miażdżycy, gdy dochodzi do istotnego zwężenia tętnic (powyżej 70-80% światła naczynia) lub gdy leczenie farmakologiczne nie przynosi oczekiwanych rezultatów, konieczne może być leczenie zabiegowe.
Angioplastyka z implantacją stentu to najczęściej wykonywany zabieg polegający na mechanicznym poszerzeniu zwężonej tętnicy za pomocą balonu wprowadzonego na cewniku, a następnie umieszczeniu w niej stentu – metalowej siateczki, która podtrzymuje światło naczynia. Obecnie stosuje się głównie stenty uwalniające leki (DES), które zmniejszają ryzyko ponownego zwężenia naczynia do około 5-10%.
Pomostowanie aortalno-wieńcowe (by-passy) to chirurgiczna metoda leczenia miażdżycy tętnic wieńcowych, szczególnie wskazana u pacjentów z wielonaczyniową chorobą wieńcową, zwężeniem pnia lewej tętnicy wieńcowej lub cukrzycą. Zabieg polega na wszczepieniu pomostów naczyniowych (najczęściej tętnicy piersiowej wewnętrznej, żyły odpiszczelowej lub tętnicy promieniowej), które omijają miejsca zwężenia i przywracają prawidłowy przepływ krwi do mięśnia sercowego.
Endarterektomia to zabieg chirurgiczny polegający na usunięciu blaszki miażdżycowej z wnętrza tętnicy. Najczęściej wykonywany jest w przypadku zwężenia tętnic szyjnych powyżej 70% w celu zapobiegania udarowi mózgu. U pacjentów z objawowym zwężeniem tętnic szyjnych endarterektomia zmniejsza ryzyko udaru o około 50-70%.
Tromboliza i trombektomia to metody stosowane w leczeniu ostrego zamknięcia tętnicy spowodowanego zakrzepem. Tromboliza polega na podaniu leku rozpuszczającego skrzeplinę (np. alteplaza), a trombektomia na jej mechanicznym usunięciu za pomocą specjalnych cewników. W przypadku udaru niedokrwiennego mózgu najważniejsze znaczenie ma czas – im wcześniej zostanie przywrócony przepływ krwi, tym większe szanse na pełne wyzdrowienie. „Czas to mózg” – każda minuta opóźnienia oznacza utratę 1,9 miliona neuronów.
Modyfikacja stylu życia – fundament leczenia
Choć nowoczesna farmakoterapia jest niezwykle skuteczna, żaden lek nie zastąpi zdrowego stylu życia. Badania jednoznacznie pokazują, że zmiana nawyków może zapobiec aż 80% przedwczesnych zgonów z powodu chorób sercowo-naczyniowych.
Dieta antymiażdżycowa powinna opierać się na modelu śródziemnomorskim, bogatym w warzywa, owoce, produkty pełnoziarniste, ryby i zdrowe tłuszcze roślinne. Należy ograniczyć spożycie nasyconych kwasów tłuszczowych (tłuste mięsa, sery, masło) i całkowicie wyeliminować tłuszcze trans (produkty typu fast food, twarde margaryny). Szczególnie korzystne jest włączenie do diety tłustych ryb morskich (łosoś, makrela, sardynki) bogatych w kwasy omega-3, olejów roślinnych (oliwa z oliwek, olej rzepakowy), orzechów, nasion oraz produktów zawierających sterole i stanole roślinne, które mogą obniżyć LDL o 5-15%. Spożycie soli powinno być ograniczone do maksymalnie 5 g dziennie, a cukrów prostych do minimum.
Regularna aktywność fizyczna to jeden z najskuteczniejszych sposobów na poprawę zdrowia sercowo-naczyniowego. Zalecane jest minimum 150 minut umiarkowanego wysiłku aerobowego tygodniowo (30-60 minut przez 5-7 dni) lub 75 minut intensywnego wysiłku. Najlepsze efekty przynosi marsz, pływanie, jazda na rowerze, nordic walking. Dodatkowo wskazane są ćwiczenia siłowe 2-3 razy w tygodniu, które poprawiają metabolizm i redukują insulinooporność.
Zaprzestanie palenia tytoniu to najskuteczniejsza pojedyncza interwencja w prewencji miażdżycy. Od momentu rzucenia nałogu w wieku 45 lat możliwy jest zysk 3-5 lat życia. Już po roku od zaprzestania palenia ryzyko choroby wieńcowej spada o połowę, a po 15 latach jest porównywalne z osobami niepalącymi.
Kontrola masy ciała jest kluczowa – obniżenie masy ciała o 1 kg powoduje spadek ciśnienia o 1 mmHg. U osób z otyłością nawet 5-10% redukcja masy ciała prowadzi do istotnej poprawy parametrów metabolicznych. Najlepszym przykładem są operacje bariatryczne, dzięki którym udaje się uzyskać wyleczenie z nadciśnienia u znacznej grupy chorych.
Redukcja stresu poprzez techniki relaksacyjne (mindfulness, medytacja, joga), odpowiednią ilość snu (7-8 godzin) oraz dbałość o zdrowie psychiczne mają udowodniony korzystny wpływ na układ sercowo-naczyniowy.
Profilaktyka miażdżycy
Profilaktyka miażdżycy powinna rozpoczynać się już w dzieciństwie, gdyż pierwsze zmiany miażdżycowe mogą pojawiać się już w tym okresie życia. Kształtowanie zdrowych nawyków żywieniowych i zachęcanie do aktywności fizycznej od najmłodszych lat to najlepsza inwestycja w przyszłe zdrowie.
U dorosłych regularne badania kontrolne powinny rozpocząć się od 40. roku życia, a w przypadku obciążeń rodzinnych lub innych czynników ryzyka – znacznie wcześniej. Podstawowe badania profilaktyczne obejmują pomiar ciśnienia tętniczego (przynajmniej raz w roku), lipidogram (co 5 lat u osób bez czynników ryzyka, częściej przy ich obecności), poziom glukozy na czczo oraz ocenę masy ciała i obwodu talii.
Program Profilaktyki Chorób Układu Krążenia (CHUK) dostępny od 35. roku życia oraz Profilaktyka 40 Plus oferują kompleksowe badania przesiewowe finansowane przez NFZ, które pozwalają na wczesne wykrycie czynników ryzyka i wdrożenie odpowiednich działań zapobiegawczych.
Osoby z rozpoznaną miażdżycą lub wysokim ryzykiem sercowo-naczyniowym powinny wykonywać lipidogram co 3-6 miesięcy, pomiar ciśnienia co 3-6 miesięcy u leczonych z powodu nadciśnienia (raz w roku u osób z prawidłowym ciśnieniem), a badania obrazowe (USG Doppler tętnic szyjnych, echokardiografia) co 1-2 lata lub częściej w przypadku niepokojących objawów.
Perspektywy przyszłości – szczepionka na miażdżycę
Jednym z najbardziej obiecujących kierunków badań nad nowymi metodami leczenia miażdżycy jest szczepionka opracowywana przez zespół prof. Macieja Banacha z Uniwersytetu Medycznego w Łodzi. Preparat celuje w obniżenie poziomu cholesterolu LDL poprzez hamowanie białka PCSK9. Po serii udanych badań przedklinicznych na zwierzętach, w połowie stycznia 2024 roku szczepionka wkroczyła w fazę badań klinicznych u ludzi. Gdyby badania potwierdziły jej skuteczność i bezpieczeństwo, szczepionka mogłaby w przyszłości stanowić przełomową alternatywę dla codziennego przyjmowania leków, szczególnie dla pacjentów, którzy mają problemy z regularnym stosowaniem farmakoterapii. Chociaż do wprowadzenia szczepionki do rutynowej praktyki klinicznej może minąć jeszcze kilka lat, już teraz daje ona nadzieję na nowe możliwości w walce z miażdżycą.
Czy miażdżycę można całkowicie wyleczyć?
Miażdżyca jest chorobą przewlekłą, której nie można całkowicie wyleczyć, ale można bardzo skutecznie hamować jej rozwój i zapobiegać groźnym powikłaniom. Nowoczesne metody leczenia farmakologicznego w połączeniu z modyfikacją stylu życia pozwalają na stabilizację, a nawet częściową regresję blaszek miażdżycowych. Badania wewnątrzwieńcowe (IVUS) wykazały, że intensywne leczenie statynami prowadzące do obniżenia cholesterolu LDL poniżej 70 mg/dl może skutkować zmniejszeniem objętości blaszek miażdżycowych średnio o 7-10%. Kluczem do sukcesu jest wczesne rozpoczęcie leczenia i konsekwentne przestrzeganie zaleceń lekarskich przez całe życie.
W jakim wieku należy rozpocząć profilaktykę miażdżycy?
Profilaktyka miażdżycy powinna zaczynać się już w dzieciństwie poprzez kształtowanie zdrowych nawyków żywieniowych, zachęcanie do regularnej aktywności fizycznej i unikanie ekspozycji na dym tytoniowy. Badania autopsyjne pokazują, że pierwsze zmiany miażdżycowe mogą pojawiać się już przed 10. rokiem życia. U dorosłych regularne badania kontrolne (lipidogram, pomiar ciśnienia tętniczego) zaleca się rozpocząć od 40. roku życia. U osób z obciążeniami rodzinnymi (przypadki wczesnych zawałów czy udarów w rodzinie), otyłością, cukrzycą lub innymi czynnikami ryzyka badania profilaktyczne powinny być rozpoczęte znacznie wcześniej – nawet w wieku 20-30 lat.
Jak szybko działają leki stosowane w leczeniu miażdżycy?
Efekt działania poszczególnych leków pojawia się z różną szybkością. Statyny zaczynają obniżać poziom cholesterolu LDL już po kilku dniach przyjmowania, ale pełny efekt terapeutyczny jest widoczny dopiero po 4-6 tygodniach. Leki przeciwpłytkowe, takie jak kwas acetylosalicylowy, zaczynają działać w ciągu kilku godzin od podania pierwszej dawki. Leki hipotensyjne obniżają ciśnienie w ciągu kilku dni do tygodni, choć optymalne wartości osiąga się często dopiero po kilku tygodniach terapii. Jednak najważniejszy jest długoterminowy efekt leczenia – stabilizacja blaszek miażdżycowych i redukcja ryzyka sercowo-naczyniowego to proces, który wymaga systematycznego przyjmowania leków przez wiele miesięcy i lat.
Czy dieta może zastąpić leki w leczeniu miażdżycy?
U osób z niewielkimi zmianami miażdżycowymi i nieznacznie podwyższonym poziomem cholesterolu odpowiednia dieta i aktywność fizyczna mogą być wystarczające do normalizacji parametrów lipidowych. Badania pokazują, że dieta śródziemnomorska bogata w sterole roślinne, błonnik rozpuszczalny, nienasycone kwasy tłuszczowe i orzechy może obniżyć poziom cholesterolu LDL o 10-15%, co u niektórych pacjentów pozwala uniknąć farmakoterapii. Jednak u osób z zaawansowaną miażdżycą, wysokim ryzykiem sercowo-naczyniowym, znacznie podwyższonym poziomem cholesterolu (szczególnie powyżej 190 mg/dl) lub z hipercholesterolemią rodzinną sama dieta nie jest wystarczająca. W takich przypadkach konieczne jest wdrożenie leków hipolipemizujących, które działają znacznie silniej niż jakiekolwiek modyfikacje dietetyczne. Należy pamiętać, że dieta i leki nie wykluczają się wzajemnie – ich połączenie daje najlepsze rezultaty terapeutyczne.
Czy miażdżyca może dotyczyć dzieci i młodzieży?
Tak, pierwsze zmiany miażdżycowe w postaci nacieczeń tłuszczowych mogą pojawiać się już w dzieciństwie i okresie dojrzewania, szczególnie u dzieci z czynnikami ryzyka takimi jak otyłość, nieprawidłowa dieta bogata w tłuszcze nasycone, brak aktywności fizycznej czy obciążenia rodzinne. Badania autopsyjne u młodych osób, które zginęły w wypadkach, wykazały obecność wczesnych zmian miażdżycowych już w wieku nastoletnim. Objawowa miażdżyca u dzieci występuje jednak bardzo rzadko i dotyczy głównie przypadków ciężkich zaburzeń lipidowych uwarunkowanych genetycznie, takich jak rodzinna hipercholesterolemia homozygotyczna. U takich dzieci poziom cholesterolu LDL może przekraczać 500 mg/dl, co bez leczenia prowadzi do rozwoju ciężkiej miażdżycy i powikłań sercowo-naczyniowych już w pierwszych dekadach życia.
Jaki jest związek między miażdżycą a zawałem serca lub udarem mózgu?
Miażdżyca jest bezpośrednią przyczyną zdecydowanej większości zawałów serca i udarów niedokrwiennych mózgu. Mechanizm jest następujący: niestabilna blaszka miażdżycowa w tętnicy wieńcowej lub mózgowej ulega pęknięciu, co prowadzi do odsłonięcia jej wnętrza. Organizm reaguje na to jak na uszkodzenie naczynia i uruchamia proces krzepnięcia krwi. Powstały zakrzep (skrzeplina) może całkowicie zamknąć światło naczynia, odcinając dopływ krwi do mięśnia sercowego lub mózgu. W przypadku zawału serca martwica mięśnia rozwija się już w 15-30 minut po zatrzymaniu dopływu krwi. W przypadku udaru mózgu każda minuta opóźnienia w leczeniu oznacza utratę prawie 2 milionów neuronów. Paradoksalnie, to często młode blaszki, które nie powodują jeszcze istotnego zwężenia naczynia, są najbardziej niebezpieczne, gdyż są bardziej podatne na pęknięcie. Dlatego zawał czy udar mogą pojawić się nagle, bez wcześniejszych objawów, u osoby, która nigdy wcześniej nie miała problemów z sercem.
Czy statyny są bezpieczne przy długotrwałym stosowaniu?
Statyny należą do najlepiej przebadanych leków na świecie i ich bezpieczeństwo przy długotrwałym stosowaniu zostało potwierdzone w licznych badaniach klinicznych trwających nawet kilkanaście lat. Najczęstszym działaniem niepożądanym są bóle mięśniowe, które występują u 5-10% pacjentów i zazwyczaj ustępują po zmniejszeniu dawki lub zmianie na inną statynę. Podwyższenie enzymów wątrobowych zdarza się u około 1-3% leczonych, ale rzadko wymaga przerwania terapii. Istnieje również niewielkie zwiększenie ryzyka rozwoju cukrzycy typu 2 przy długotrwałym stosowaniu wysokich dawek statyn, jednak korzyści z redukcji ryzyka sercowo-naczyniowego znacznie przewyższają to ryzyko. Bardzo rzadkim, ale groźnym powikłaniem jest rabdomioliza (rozpad mięśni), która występuje u około 1 na 10 000 leczonych pacjentów rocznie. W odniesieniu do korzyści płynących z działania statyn oraz powikłań nieleczonej miażdżycy lekarze uznają, że korzyści znacznie przewyższają potencjalne działania niepożądane.
Czy suplementy diety są skuteczne w leczeniu miażdżycy?
Wiele suplementów diety jest reklamowanych jako środki wspomagające leczenie miażdżycy, jednak ich skuteczność jest ograniczona i nie dorównuje lekom przepisywanym przez lekarza. Najlepiej przebadanymi suplementami o pewnym działaniu korzystnym są stanole i sterole roślinne (mogą obniżać LDL o 5-15%), czerwony ryż drożdżowy (zawiera naturalną lowastatynę, ale jego jakość i dawkowanie są trudne do standaryzacji), koenzym Q10 (może zmniejszać bóle mięśniowe u osób przyjmujących statyny) oraz kwasy omega-3 w wysokich dawkach (działanie przeciwzapalne i obniżające trójglicerydy). Suplementy te mogą być stosowane jako uzupełnienie farmakoterapii i zdrowego stylu życia, ale nie powinny ich zastępować. Co bardzo ważne, przed rozpoczęciem suplementacji należy skonsultować się z lekarzem, gdyż niektóre suplementy mogą wchodzić w interakcje z lekami lub powodować działania niepożądane.
Czy osoby przyjmujące leki na miażdżycę muszą je brać do końca życia?
W większości przypadków tak – miażdżyca jest chorobą przewlekłą, a leki zapobiegają jej postępowi i chronią przed groźnymi powikłaniami. Przerwanie farmakoterapii, nawet gdy parametry lipidowe czy ciśnienie tętnicze są prawidłowe, prowadzi do szybkiego powrotu zaburzeń i wznowienia procesu chorobowego. Badania jasno pokazują, że korzyści z leczenia utrzymują się tylko tak długo, jak długo pacjent systematycznie przyjmuje leki. U osób, które przerwały terapię statynami po zawale serca, ryzyko kolejnego zawału lub zgonu wzrasta o 25-50%. Jedynym wyjątkiem mogą być pacjenci z bardzo niskim ryzykiem sercowo-naczyniowym, u których udało się osiągnąć znaczącą i trwałą poprawę poprzez radykalną zmianę stylu życia (znaczna utrata masy ciała, zaprzestanie palenia, regularna intensywna aktywność fizyczna) – w takich przypadkach lekarz może rozważyć zmniejszenie dawki lub odstawienie leków, ale zawsze pod ścisłą kontrolą parametrów laboratoryjnych.
Jak często należy wykonywać badania kontrolne przy miażdżycy?
Częstotliwość badań kontrolnych zależy od stopnia zaawansowania choroby, obecności czynników ryzyka oraz efektów leczenia. Osoby z rozpoznaną miażdżycą lub bardzo wysokim ryzykiem sercowo-naczyniowym powinny wykonywać lipidogram co 3-6 miesięcy, szczególnie po rozpoczęciu nowej terapii lub modyfikacji leczenia. Po osiągnięciu stabilnych, docelowych wartości cholesterolu kontrole mogą być rzadsze – co 6-12 miesięcy. Pomiar ciśnienia tętniczego zaleca się co 3-6 miesięcy u osób leczonych z powodu nadciśnienia, a u osób z prawidłowym ciśnieniem przynajmniej raz w roku. Badania obrazowe, takie jak USG Doppler tętnic szyjnych czy echokardiografia, wykonuje się zwykle co 1-2 lata, chyba że pojawiają się niepokojące objawy wymagające wcześniejszej diagnostyki. U pacjentów przyjmujących statyny kontrola enzymów wątrobowych i kinazy kreatynowej (CK) powinna być wykonywana po 4-6 tygodniach od rozpoczęcia leczenia lub zwiększenia dawki, a następnie przynajmniej raz w roku.
Czy nadciśnienie tętnicze zawsze wymaga leczenia farmakologicznego?
Nie zawsze – decyzja o rozpoczęciu leczenia farmakologicznego zależy od wartości ciśnienia, obecności czynników ryzyka oraz uszkodzeń narządowych. U osób z ciśnieniem skurczowym 130-139 mmHg i rozkurczowym 85-89 mmHg (tzw. ciśnienie prawidłowe wysokie) bez innych czynników ryzyka wystarczająca może być modyfikacja stylu życia: redukcja masy ciała, ograniczenie soli, zwiększenie aktywności fizycznej, zaprzestanie palenia. Leki są bezwzględnie wskazane, gdy ciśnienie przekracza 140/90 mmHg mimo zmiany stylu życia lub gdy już przy pierwszym pomiarze wartości są bardzo wysokie (powyżej 160/100 mmHg). U pacjentów z dodatkowymi czynnikami ryzyka, takimi jak cukrzyca, przewlekła choroba nerek, po zawale serca czy udarze mózgu, farmakoterapia powinna być wdrożona nawet przy niższych wartościach ciśnienia. Pamiętajmy, że obniżenie ciśnienia o każde 10 mmHg zmniejsza ryzyko zawału serca o 20% i udaru mózgu o 30%.
Bibliografia
- Visseren FLJ, Mach F, Smulders YM, Carballo D, Koskinas KC, Bäck M, Benetos A, Biffi A, Boavida JM, Capodanno D, Cosyns B, Crawford C, Davos CH, Desormais I, Di Angelantonio E, Franco OH, Halvorsen S, Hobbs FDR, Hollander M, Jankowska EA, Michal M, Sacco S, Sattar N, Tokgozoglu L, Tonstad S, Tsioufis KP, van Dis I, van Gelder IC, Wanner C, Williams B; ESC Scientific Document Group. 2021 ESC Guidelines on cardiovascular disease prevention in clinical practice. Eur Heart J. 2021;42(34):3227-3337. DOI: 10.1093/eurheartj/ehab484 PMID: 34458905
- Shepherd J, Cobbe SM, Ford I, Isles CG, Lorimer AR, MacFarlane PW, McKillop JH, Packard CJ. Prevention of coronary heart disease with pravastatin in men with hypercholesterolemia. West of Scotland Coronary Prevention Study Group. N Engl J Med. 1995;333(20):1301-1307. DOI: 10.1056/NEJM199511163332001 PMID: 7566020
- Sabatine MS, Giugliano RP, Keech AC, Honarpour N, Wiviott SD, Murphy SA, Kuder JF, Wang H, Liu T, Wasserman SM, Sever PS, Pedersen TR; FOURIER Steering Committee and Investigators. Evolocumab and Clinical Outcomes in Patients with Cardiovascular Disease. N Engl J Med. 2017;376(18):1713-1722. DOI: 10.1056/NEJMoa1615664 PMID: 28304224
- Marx N, Federici M, Schütt K, Müller-Wieland D, Ajjan RA, Antunes MJ, Christodorescu RM, Crawford C, Di Angelantonio E, Eliasson B, Espinola-Klein C, Fauchier L, Halle M, Herrington WG, Kautzky-Willer A, Lambrinou E, Lesiak M, Lettino M, McGuire DK, Mullens W, Rocca B, Sattar N; ESC Scientific Document Group. 2023 ESC Guidelines for the management of cardiovascular disease in patients with diabetes. Eur Heart J. 2023;44(39):4043-4140. DOI: 10.1093/eurheartj/ehad192 PMID: 37622663
- Effect of simvastatin on coronary atheroma: the Multicentre Anti-Atheroma Study (MAAS). Lancet. 1994;344(8923):633-638. PMID: 7864934

